Disproportionierung
Bei der chemischen Reaktion der Disproportionierung, Synonym: Dismutation, tritt im Rahmen einer Redoxreaktion ein Element gleichzeitig als Oxidationsmittel und als Reduktionsmittel auf, so dass es vorher in einer mittleren Oxidationsstufe, nachher teils in einer erhöhten und teils in einer niedrigeren Oxidationsstufe vorliegt. Die Atome werden also teils oxidiert, teils reduziert. Der umgekehrte Fall nennt sich Komproportionierung oder Synproportionierung.[1]
Inhaltsverzeichnis
1 Beispiele
2 Radikalische Disproportionierung
3 Cannizzaro-Reaktion
4 Weblinks
5 Einzelnachweise
Beispiele |
Ein Beispiel ist die Reaktion von Chlor in Natronlauge. Dabei wird eines der beiden Chlor-Atome des Chlormoleküls mit der Oxidationszahl 0 zum Chlorid-Ion mit der Oxidationszahl −I reduziert, das andere Chlor-Atom zur Oxidationsstufe +I (Hypochlorit-Ion) oxidiert.
- Cl±02(g) + 2 NaOH(aq) →▽ NaCl−I(s)+NaCl+IO(s)+ H2O(l){displaystyle {stackrel {mathrm {pm 0} }{mathrm {Cl} }}mathrm {_{2,(g)} + 2 NaOH_{mathrm {(aq)} } {xrightarrow {bigtriangledown }} Na} {stackrel {mathrm {-I} }{mathrm {Cl} }}_{mathrm {(s)} }+mathrm {Na} {stackrel {mathrm {+I} }{mathrm {Cl} }}mathrm {O_{(s)}+ H_{2}O_{(l)}} }
- Chlor reagiert in kalter Natronlauge zu Natriumchlorid, Natriumhypochlorit und Wasser (exotherm).
In warmer Natronlauge reagiert Natriumhypochlorit weiter zu Natriumchlorat.
Ein praktisches Beispiel ist die Wasseraufbereitung im Schwimmbad. Bei der Einleitung von Chlor in Wasser bildet sich in Abhängigkeit vom pH-Wert ein Gleichgewicht aus Chlor, Hypochloriger Säure und Salzsäure:[2]
- Cl2+H2O→ HClO+HCl{displaystyle mathrm {Cl_{2}+H_{2}Oto HClO+HCl} }
Je nach pH-Wert dissoziiert die Hypochlorige Säure teilweise zu Oxonium- und Hypochlorit-Ionen:
- HClO+H2O→ H3O++ClO−{displaystyle mathrm {HClO+H_{2}Oto H_{3}O^{+}+ClO^{-}} }
Als weiteres Beispiel ist Folgendes zu nennen:
- 4 KCl+VO3(s) →▽ KCl−I(s)+3 KCl+VIIO4(s){displaystyle 4 mathrm {K} {stackrel {mathrm {+V} }{mathrm {Cl} }}mathrm {O} _{mathrm {3,(s)} } {xrightarrow {bigtriangledown }} mathrm {K} {stackrel {mathrm {-I} }{mathrm {Cl} }}_{mathrm {(s)} }+3 mathrm {K} {stackrel {mathrm {+VII} }{mathrm {Cl} }}mathrm {O_{4,(s)}} }
- Kaliumchlorat reagiert zu Kaliumchlorid und Kaliumperchlorat (exotherm).
Radikalische Disproportionierung |
Ein Spezialfall ist die radikalische Disproportionierung in der organischen Chemie:[1][3]

Cannizzaro-Reaktion |
Bei der Cannizzaro-Reaktion disproportionieren Aldehyde, die kein Wasserstoffatom in α-Stellung zum aldehydischen Kohlenstoffatom besitzen, in Gegenwart von starken Basen wie konzentrierter Natronlauge. Als Oxidationsprodukt entsteht das entsprechende Salz einer Carbonsäure (z. B. Natriumsalz), als Reduktionsprodukt der Alkohol:[4]
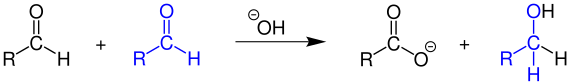
Ist jedoch ein α-ständiges Wasserstoffatom im Aldehyd vorhanden, wird die Aldolreaktion bevorzugt.
Weblinks |
- Beschreibung der Disproportionierung bei Chemgapedia
Einzelnachweise |
↑ ab Eintrag zu disproportionation. In: IUPAC Compendium of Chemical Terminology (the “Gold Book”). doi:10.1351/goldbook.D01799 Version: 2.1.5.
↑ Fair, G. M., J. Corris, S. L. Chang, I. Weil, and R. P. Burden. 1948. The behavior of chlorine as a water disinfectant. J. Am. Water Works Assoc. 40:1051–1061.
↑ Organikum, Wiley-VCH Verlag GmbH, 23. Auflage, 2009, S. 194, ISBN 978-3-527-32292-3.
↑ László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3, S. 74.



