Trioxan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trioxan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
Summenformel | C3H6O3 | |||||||||||||||
| Kurzbeschreibung | leichtentzündlicher, weißer Feststoff mit ethanolähnlichem Geruch [1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
Molare Masse | 90,08 g·mol−1 | |||||||||||||||
Aggregatzustand | fest | |||||||||||||||
Dichte | 1,17 g·cm−3 (65 °C) [1] | |||||||||||||||
Schmelzpunkt | 62 °C [1] | |||||||||||||||
Siedepunkt | 115 °C [1] | |||||||||||||||
Dampfdruck | 11 hPa (20 °C)[2] | |||||||||||||||
Löslichkeit | gut in Wasser (221 g·l−1 bei 25 °C) [1] | |||||||||||||||
Dipolmoment | 2,08(2) D[3] (6,9 · 10−30 C · m) | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
Toxikologische Daten |
| |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
ΔHf0 | −522,5 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Trioxan ist eine heterocyclische Verbindung aus der Stoffgruppe der Acetale, die durch Trimerisierung von Formaldehyd entsteht. Die IUPAC-Bezeichnung lautet 1,3,5-Trioxacyclohexan oder kurz 1,3,5-Trioxan. Auch die cyclischen Trimere anderer Aldehyde werden als Trioxane bezeichnet.
Darstellung, Eigenschaften und Verwendung |
Die Herstellung von Trioxan erfolgt säurekatalytisch durch eine Trimerisierung von Formaldehyd.[6]
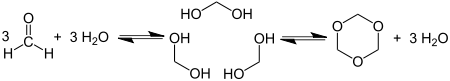
Die Herstellung erfolgt außerdem direkt aus Methanol durch Dehydrierung oder durch Oxidation mit Luftsauerstoff.[6] Die leichtentzündliche Substanz bildet farblose Nadeln, die sich gut in Wasser, Alkohol und Ether lösen. Beim Erhitzen auf 150 bis 200 °C in Gegenwart von Wasser depolymerisiert Trioxan wieder zu monomerem Formaldehyd. Dies stellt vor allem bei unsachgemäßer Lagerung von Trockenbrennstoffen, die Trioxan enthalten, ein Gefahrenpotenzial dar, siehe dazu Esbitkocher. Wegen der katalytischen Wirkung basischer Stoffe sind insbesondere Reinigungsmittel unbedingt getrennt von Trockenbrennstoffen aufzubewahren.
Trioxan wird zur Herstellung von Polyacetal-Kunststoffen verwendet. Auch in Synthesen, die von Formaldehyd ausgehen und diesen in sehr reiner Form benötigen, wird Trioxan eingesetzt.
Sicherheitshinweise |
Trioxan ist sehr leicht entzündlich. Die Dämpfe sind im Gemisch mit Luft im weiten Konzentrationsbereich von 3,6 bis 29 Volumen-% explosiv.[1] Trioxan reizt Haut, Schleimhäute und Augen und kann beim Einatmen der Dämpfe die Atemwege und das Zentralnervensystem schädigen. Die Auswirkungen von Trioxan auf die menschliche Gesundheit und die Umwelt wurden unter REACH im Jahr 2013 im Rahmen der Stoffbewertung von Polen geprüft. Nach Abschluss der Prüfung wurde empfohlen, Trioxan zusätzlich in die Kategorie 2 – Augenreizend einzustufen.[2]
Einzelnachweise |
↑ abcdefghij Eintrag zu 1,3,5-Trioxan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016 (JavaScript erforderlich).
↑ ab Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 1,3,5-trioxane, abgerufen am 30. Oktober 2016.
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-58.
↑ Eintrag zu 1,3,5-trioxane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
↑ ab Eintrag zu Formaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Februar 2014.


